Раніцай 29 снежня NEJM апублікаваў у інтэрнэце вынікі новага клінічнага даследавання трэцяй фазы новага кітайскага каранавіруса VV116. Вынікі паказалі, што VV116 не горшы за Paxlovid (нематавір/рытанавір) з пункту гледжання працягласці клінічнага выздараўлення і меў менш пабочных эфектаў.
Крыніца выявы: NEJM
Сярэдні час выздараўлення 4 дні, частата неспрыяльных з'яў 67,4%
VV116 — гэта пероральны нуклеазідны прэпарат супраць новага каранавіруса (SARS-CoV-2), распрацаваны сумесна з Junsit і Wang Shan Wang Shui, які з'яўляецца інгібітарам RdRp разам з рэмдэзівірам ад Gilead, малнупіравірам ад Merck Sharp & Dohme і азелвудзінам ад Real Biologics.
У 2021 годзе ва Узбекістане была завершана другая фаза клінічных выпрабаванняў прэпарата VV116. Вынікі даследавання паказалі, што група, якая прымала VV116, магла лепш палепшыць клінічныя сімптомы і значна знізіць рызыку прагрэсавання ў крытычную форму і смерці ў параўнанні з кантрольнай групай. Зыходзячы з станоўчых вынікаў гэтага выпрабавання, VV116 быў ухвалены ва Узбекістане для лячэння пацыентаў з COVID-19 сярэдняй і цяжкай ступені і стаў першым новым пероральным прэпаратам для лячэння каранарных захворванняў, ухваленым для продажу за мяжой у Кітаі [1].
Гэта клінічнае выпрабаванне III фазы[2] (NCT05341609), якое ўзначальвалі прафесар Чжао Рэн з Шанхайскай бальніцы Руйцзінь, прафесар Гаоюань з Шанхайскай бальніцы Рэнцзі і акадэмік Нін Гуан з Шанхайскай бальніцы Руйцзінь, было завершана падчас успышкі, выкліканай варыянтам Omicron (B.1.1.529), якая праводзілася з сакавіка па май у Шанхаі. Мэта выпрабавання заключалася ў ацэнцы эфектыўнасці і бяспекі VV116 у параўнанні з Paxlovid для ранняга лячэння пацыентаў з COVID-19 лёгкай і сярэдняй цяжкасці. Мэта выпрабавання складалася ў тым, каб ацаніць эфектыўнасць і бяспеку VV116 у параўнанні з Paxlovid для ранняга лячэння пацыентаў з COVID-19 лёгкай і сярэдняй цяжкасці.
Крыніца выявы: Спасылка 2
У перыяд з 4 красавіка па 2 мая 2022 года было праведзена шматцэнтравае рандомізіраванае кантраляванае даследаванне з удзелам 822 дарослых пацыентаў з Covid-19 з высокай рызыкай прагрэсавання і лёгкімі або ўмеранымі сімптомамі, каб ацаніць права ўдзельнікаў з сямі бальніц у Шанхаі, Кітай, на ўдзел у даследаванні. У выніку 771 удзельнік атрымаў альбо VV116 (384, 600 мг кожныя 12 гадзін у 1-ы дзень і 300 мг кожныя 12 гадзін у 2-5-ы дні), альбо Paxovid (387, 300 мг німатувіру + 100 мг рытанавіру кожныя 12 гадзін на працягу 5 дзён) у якасці прэпарата для прыёму ўнутр.
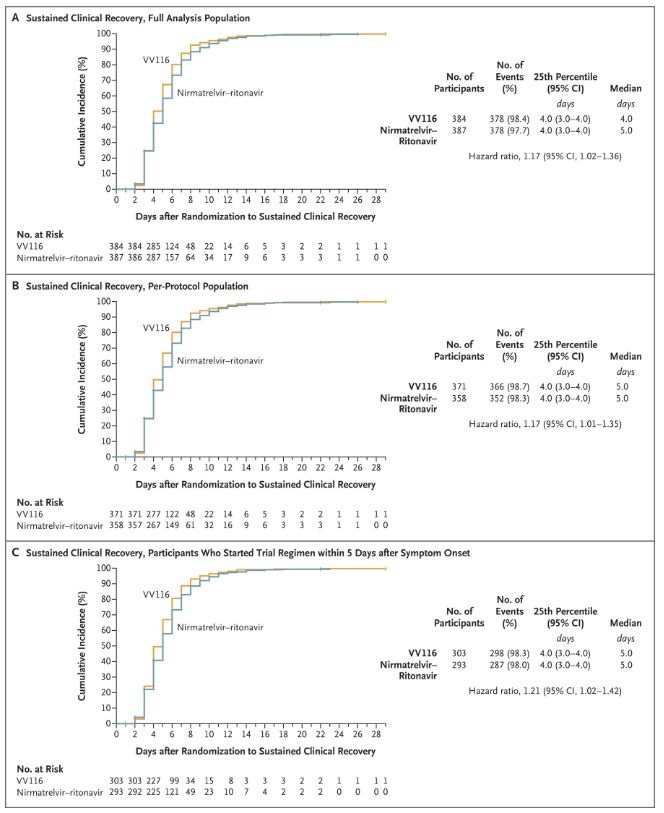
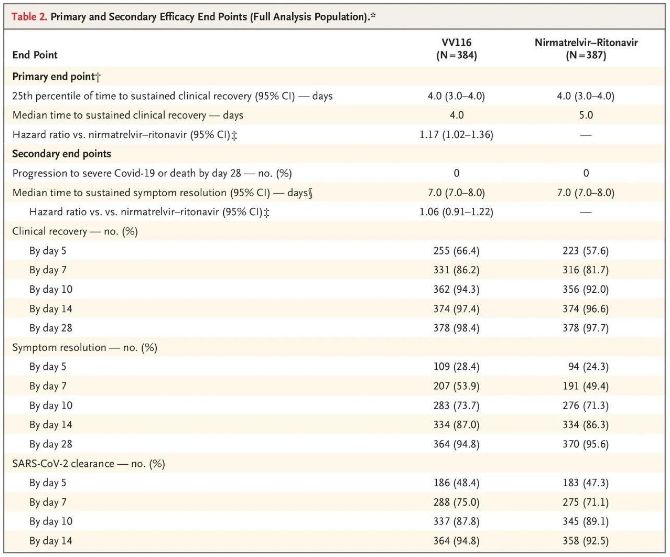
Вынікі гэтага клінічнага даследавання паказалі, што ранняе лячэнне прэпаратам VV116 лёгкай і сярэдняй цяжкасці COVID-19 дасягнула першаснай канчатковай кропкі (час да ўстойлівага клінічнага выздараўлення), прадказанай клінічным пратаколам: сярэдні час да клінічнага выздараўлення склаў 4 дні ў групе VV116 і 5 дзён у групе Paxlovid (каэфіцыент рызыкі 1,17; 95% ДІ ад 1,02 да 1,36; ніжняя мяжа >0,8).
Захаванне часу клінічнага аднаўлення
Першасныя і другасныя канчатковыя кропкі эфектыўнасці (комплексны аналіз папуляцыі)
Крыніца выявы: Спасылка 2
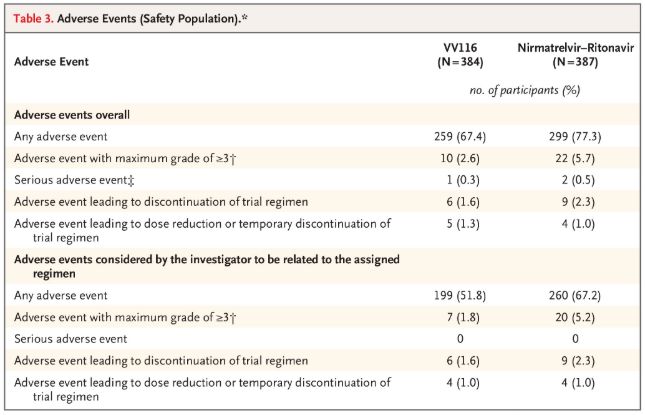
Што тычыцца бяспекі, удзельнікі, якія атрымлівалі VV116, паведамлялі пра меншую колькасць пабочных эфектаў (67,4%), чым тыя, хто атрымліваў Паксловід (77,3%), на працягу 28 дзён назірання, а частата пабочных эфектаў 3/4 ступені была ніжэйшай для VV116 (2,6%), чым для Паксловіда (5,7%).
Неспрыяльныя падзеі (бяспечныя людзі)
Крыніца выявы: Спасылка 2
Спрэчкі і пытанні
23 мая 2022 года кампанія Juniper паведаміла, што клінічнае даследаванне III фазы рэгістрацыі VV116 у параўнанні з PAXLOVID для ранняга лячэння COVID-19 лёгкай і сярэдняй цяжкасці (NCT05341609) дасягнула сваёй асноўнай канчатковай кропкі даследавання.
Крыніца выявы: Спасылка 1
У той час, калі падрабязнасці выпрабавання былі невядомыя, спрэчкі вакол даследавання трэцяй фазы былі двайнымі: па-першае, гэта было адзінарнае сляпое даследаванне, і, з-за адсутнасці плацеба-кантролю, існавалі асцярогі, што будзе цяжка цалкам аб'ектыўна ацаніць прэпарат; па-другое, узнікалі пытанні адносна клінічных канчатковых кропак.
Клінічныя крытэрыі ўключэння для прэпарата Juniper наступныя: (i) станоўчыя вынікі новага тэсту на каранавірус, (ii) адзін або некалькі лёгкіх або ўмераных сімптомаў COVID-19 і (iii) пацыенты з высокай рызыкай цяжкага COVID-19, у тым ліку смерці. Аднак адзінай першаснай клінічнай канчатковай кропкай з'яўляецца «час да ўстойлівага клінічнага выздараўлення».
Непасрэдна перад аб'явай, 14 мая, кампанія Juniper перагледзела клінічныя канчатковыя кропкі, выдаліўшы адну з першасных клінічных канчатковых кропак — «долю пераходаў да сур'ёзнай хваробы або смерці» [3].
Крыніца выявы: Спасылка 1
Гэтыя два асноўныя спрэчныя моманты таксама былі спецыяльна разгледжаны ў апублікаваным даследаванні.
З-за раптоўнага ўспышкі прэпарата «Омікрон» вытворчасць таблетак плацебо для «Паксловіду» не была завершана да пачатку выпрабаванняў, і таму даследчыкі не змаглі правесці гэта выпрабаванне з выкарыстаннем падвойнага сляпога метаду з падвойным макетам. Што тычыцца аднасляпога аспекту клінічнага выпрабавання, Джуніпер заявіў, што пратакол быў праведзены пасля ўзаемадзеяння з рэгулюючымі органамі, і што аднасляпы метад азначае, што ні даследчык (у тым ліку ацэншчык канчатковай кропкі даследавання), ні спонсар не будуць ведаць канкрэтнае размеркаванне тэрапеўтычных прэпаратаў, пакуль канчатковая база дадзеных не будзе заблакавана ў канцы даследавання.
Да моманту канчатковага аналізу ні ў аднаго з удзельнікаў выпрабавання не было смерці або прагрэсавання да цяжкай формы Covid-19, таму немагчыма зрабіць высновы аб эфектыўнасці VV116 у прадухіленні прагрэсавання да цяжкай або крытычнай формы Covid-19 або смерці. Дадзеныя паказваюць, што разліковы сярэдні час ад рандомізацыі да ўстойлівай рэгрэсіі мэтавых сімптомаў, звязаных з Covid-19, склаў 7 дзён (95% ДІ, ад 7 да 8) у абедзвюх групах (каэфіцыент рызыкі, 1,06; 95% ДІ, ад 0,91 да 1,22) [2]. Няцяжка растлумачыць, чаму першасная канчатковая кропка «частата пераходу да цяжкай формы захворвання або смерці», якая першапачаткова была ўстаноўлена да заканчэння выпрабавання, была выдалена.
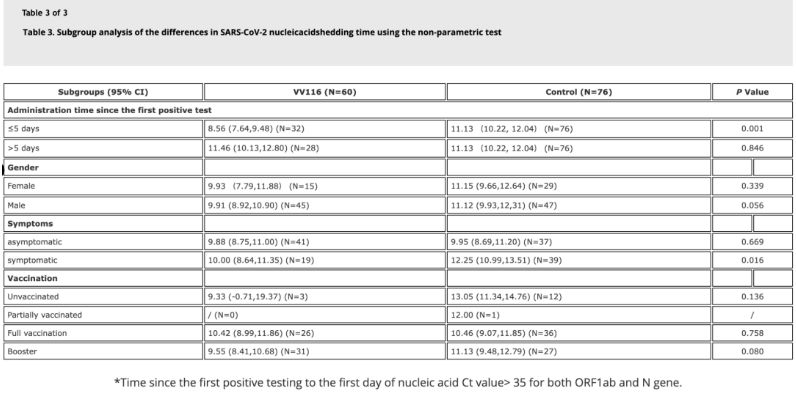
18 мая 2022 года часопіс «Emerging Microbes & Infections» апублікаваў вынікі першага клінічнага выпрабавання VV116 у пацыентаў, інфікаваных варыянтам Omicron [4], адкрытага праспектыўнага кагортнага даследавання са 136 пацверджанымі стацыянарнымі пацыентамі.
Дадзеныя даследавання паказалі, што ў пацыентаў з інфекцыяй Omicron, якія выкарыстоўвалі VV116 на працягу 5 дзён пасля першага станоўчага тэсту на нуклеінавыя кіслаты, час да рэгрэсіі нуклеінавых кіслот склаў 8,56 дня, што менш за 11,13 дня ў кантрольнай групе. Увядзенне VV116 сімптаматычным пацыентам у тэрміны гэтага даследавання (2-10 дзён пасля першага станоўчага тэсту на нуклеінавыя кіслаты) скараціла час да рэгрэсіі нуклеінавых кіслот ва ўсіх пацыентаў. Што тычыцца бяспекі прэпарата, у групе лячэння VV116 не назіралася сур'ёзных пабочных эфектаў.
Крыніца выявы: Спасылка 4
У цяперашні час праводзяцца тры клінічныя выпрабаванні прэпарата VV116, два з якіх — даследаванні III фазы пры COVID-19 лёгкай і сярэдняй цяжкасці (NCT05242042, NCT05582629). Іншае выпрабаванне пры COVID-19 сярэдняй і цяжкай цяжкасці — гэта міжнароднае шматцэнтравае рандомізірованное двайное сляпое клінічнае даследаванне III фазы (NCT05279235) для ацэнкі эфектыўнасці і бяспекі VV116 у параўнанні са стандартным лячэннем. Згодна з аб'явай Juniper, першы пацыент быў уключаны ў даследаванне і атрымаў дозу ў сакавіку 2022 года.
Крыніца выявы: clinicaltrials.gov
Спасылкі:
[1]Junshi Biotech: Паведамленне аб асноўнай канчатковай кропцы трэцяй фазы зарэгістраванага клінічнага даследавання VV116 у параўнанні з PAXLOVID для ранняга лячэння COVID-19 лёгкай і сярэдняй цяжкасці.
[2]https://www.nejm.org/doi/full/10.1056/NEJMoa2208822?query=featured_home[3]https://clinicaltrials.gov/ct2/show/record/NCT05341609[4] Ensi Ma, Jingwen Ai, Yi Zhang, Jianming Zheng, Xiaogang Gao, Цзюньмін Сюй, Хао Інь, Чжырэн Фу, Хао Сін, Лі Лі, Ліін Сунь, Хэй Хуан, Цюаньбао Чжан, Ліньлінь Сюй, Яньцін Цзінь, Руй Чэнь, Гуоюэ Лв, Чжыцзюнь Чжу, Вэньхун Чжан, Чжэнсінь Ван. (2022) Профіль інфекцый Omicron і статус вакцынацыі сярод 1881 рэцыпіентаў печані: шматцэнтравая рэтраспектыўная кагорта. Новыя мікробы і інфекцыі 11:1, старонкі 2636-2644.
Час публікацыі: 06 студзеня 2023 г.
 中文网站
中文网站